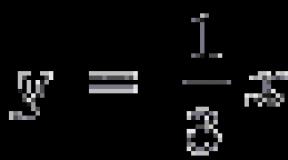Химия. Смотреть что такое "сера" в других словарях Нахождение в природе, получение
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
Оксид серы - это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO 2 (серный диоксид или сернистый газ) и SO 3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.
Общие данные о моноокисиде серы
Двухвалентный серный монооксид, или иначе серная моноокись - это неорганическое вещество, состоящее из двух простых элементов - серы и кислорода. Формула - SO. В условиях нормальной обстановки является газом без цвета, но с резким и специфическим запахом. Вступает в реакции с водным раствором. Довольно редкое соединение в земной атмосфере. К воздействию температур неустойчив, существует в димерной форме - S 2 O 2 . Иногда способен, взаимодействуя с кислородом, в результате реакции образовывать диоксид серы. Солей не образует.

Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
- 2S2+O 2 = 2SO;
- 2SO2 = 2SO+O2.
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
- S 2 O 2 +H 2 O = H 2 S 2 O 3 .
Общие данные о сернистом газе
Оксид серы - очередная форма оксидов серы с химической формулой SO 2 . Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.

В промышленности получают сжиганием серы или обжигом ее сульфидов:
- 2FeS 2 +5O 2 = 2FeO+4SO 2 .
В лабораториях, как правило, SO 2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H 2 SO 4 .
Как и другие серные оксиды, SO 2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO 2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей - это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.

SO 2 - довольно токсичное соединение. Характерные симптомы, указывающие на отравление им, - это откашливание, появление проблем с дыханием, как правило, в виде насморка, охриплости, появление необычного привкуса и першение в горле. Вдыхание такого газа может вызвать удушье, нарушение речевой способности индивида, рвоту, затруднение процесса глотания, а также легочный отек в острой форме. Максимально допустимой концентрацией этого вещества в рабочем помещении является 10мг/м 3 . Однако у различных людей организм может проявлять и разную чувствительность к сернистому газу.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, - это высший оксид серы с химической формулой SO 3 . Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.

Детальный разбор высшего оксида
При окислении SO 2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V 2 O 5 , Fe 2 O 3 , NaVO 3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO 2:
- Fe 2 (SO 4)3 = Fe 2 O 3 +3SO 3 ;
- SO 2 +O 3 = SO 3 +O 2 .
Окисление SO 2 при помощи NO 2:
- SO 2 +NO 2 = SO 3 +NO.
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D 3 h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO 3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO 3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
- 2KHO+SO 3 = K 2 SO 4 +H 2 O;
- CaO+SO 3 = CaSO 4 .
Высший серный оксид SO 3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
- SO 3 +H 2 O = H2SO 4.
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
- SO 3 +HCl = HSO 3 Cl.
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO 3 , образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
Выполнила
студентка группы СВ-53
Руководитель семинаров по химии
Кафедры химии
Профессор В.Ф. Захаров
Москва, 2002
Нахождение серы в природе.
Физические свойства серы.
Химические свойства серы и ее соединений.
1) Свойства простого вещества.
Свойства оксидов:
оксид серы (IV);
оксид серы (VI).
Свойства кислот и их солей:
сернистая кислота и ее соли;
сероводород и сульфиды;
серная кислота и ее соли.
Использование серы в медицине.
Общая характеристика подгруппы кислорода
В подгруппу кислорода входят пять элементов: кислород, сера, селен, теллур и полоний (полоний – радиоактивный элемент). Это p-элементы VI группы периодической системы Д.И. Менделеева. Они имеют групповое название – халькогены, что означает «образующие руды».
Свойства элементов подгруппы кислорода
|
Свойства |
|||||
|
Порядковый номер |
|||||
|
Валентные электроны |
|||||
|
Энергия ионизации атома, эВ |
|||||
|
Относительная электроотрицательность |
|||||
|
Степень окисления в соединениях |
|||||
|
Радиус атома, нм |
У атомов халькогенов одинаковое строение внешнего энергетического уровня – ns 2 np 4 . Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления –2, а в соединениях с кислородом и другими активными неметаллами – обычно +4 и +6. для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно –2 и в соединениях с фтором +2.
Водородные соединения элементов подгруппы кислорода отвечают формуле H 2 R (R – символ элемента): H 2 O , H 2 S , H 2 Se , H 2 Te . Они называются хальководородами. При растворении их в воде образуются кислоты (формулы те же). Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений H 2 R . Вода, диссоциирующая на ионы H + и ОН - , является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RO 2 и RO 3 . Им соответствуют кислоты типа H 2 RO 3 и H 2 RO 4 . С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа H 2 RO 3 также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур – неметаллы, но последний обладает металлическим блеском и проводит электрический ток.
Сера
СЕ́РА -ы; ж.
1. Химический элемент (S); легко воспламеняющееся вещество жёлтого цвета (применяется в промышленности, военном деле, сельском хозяйстве, медицине).
2. Жёлтое жирное вещество, образующееся на стенках ушного канала. Прочистить от серы уши.
◁ Се́рный (см.).
се́ра(лат. Sulfur), химический элемент VI группы периодической системы. Жёлтые кристаллы. Устойчива в двух модификациях - ромбической (плотность 2,07 г/см 3 , t пл 112,8°C) и моноклинной (плотность 1,96 г/см 3 , t пл 119°C). В воде нерастворима. На воздухе устойчива; при горении даёт SO 2 , с металлами образует сульфиды. В природе - самородная сера, сульфиды, сульфаты. Серу выплавляют из самородных руд; получают также окислением кислородом воздуха сероводорода, содержащегося в природном, нефтяном, коксовом газах, и другими методами. Около 50% серы идёт на получение серной кислоты, 25% - на получение сульфитов (используются в бумажной промышленности), остальная - для борьбы с болезнями растений, вулканизации, синтеза красителей, производства спичек и др.
СЕРАСЕ́РА (лат. Sulfur), S, химический элемент с атомным номером 16, атомная масса 32,066. Химический символ серы S произносится «эс». Природная сера состоит из четырех стабильных нуклидов (см.
НУКЛИД)
: 32 S (содержание 95,084% по массе), 33 S (0,74 %), 34 S (4,16%) и 36 S (0,016 %).
Радиус атома серы 0,104 нм. Радиусы ионов: иона S 2– 0,170 нм (координационное число 6), иона S 4+ 0,051 нм (координационное число 6) и иона S 6+ 0,026 нм (координационное число 4). Энергии последовательной ионизации нейтрального атома серы от S 0 до S 6+ равны, соответственно, 10,36, 23,35, 34,8, 47,3, 72,5 и 88,0 эВ. Сера расположена в VIA группе периодической системы Д. И. Менделеева, в 3-м периоде, и принадлежит к числу халькогенов. Конфигурация внешнего электронного слоя 3s
2
3p
4
. Наиболее характерны степени окисления в соединениях –2, +4, +6 (валентности соответственно II, IV и VI). Значение электроотрицательности серы по Полингу 2,6. Сера относится к числу неметаллов.
В свободном виде сера представляет собой желтые хрупкие кристаллы или желтый порошок.
Историческая справка
Сера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже в глубокой древности. Сера привлекала внимание характерной окраской, голубым цветом пламени и специфическим запахом, возникающим при горении (запах сернистого газа). Считалось, что горящая сера отгоняет нечистую силу. В Библии говорится об использовании серы для очищения грешников. У человека средневековья запах «серы» ассоциировался с преисподней. Применение горящей серы для дезинфекции упоминается Гомером. В Древнем Риме с помощью сернистого газа отбеливали ткани.
Издавна использовалась сера в медицине - ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний. В 11 в. Авиценна (Ибн Сина (см.
ИБН СИНА)
), а затем и европейские алхимики полагали, что металлы, в том числе золото и серебро, состоят из находящихся в различных соотношениях серы и ртути. Поэтому сера играла важную роль в попытках алхимиков найти «философский камень» и превратить недрагоценные металлы в драгоценные. В 16 в. Парацельс (см.
ПАРАЦЕЛЬС)
считал серу наряду с ртутью и «солью» одним из основных «начал» природы, «душою» всех тел.
Практическое значение серы резко возросло после того, как изобрели черный порох (в состав которого обязательно входит сера). Византийцы в 673 г., защищая Константинополь, сожгли флот неприятеля с помощью так называемого греческого огня - смеси селитры, серы, смолы и других веществ - пламя которого не гасилось водой. В средние века в Европе применялся черный порох, по составу близкий к смеси греческого огня. С тех пор началось широкое использование серы для военных целей.
Издавна было известно и важнейшее соединение серы - серная кислота. Один из создателей ятрохимии (см.
ЯТРОХИМИЯ)
, монах Василий Валентин, в 15 в. подробно описал получение серной кислоты путем прокаливания железного купороса (старинное название серной кислоты - купоросное масло).
Элементарную природу серы установил в 1789 А. Лавуазье (см.
ЛАВУАЗЬЕ Антуан Лоран)
. В названиях химических соединений, содержащих серу, часто содержится приставка «тио» (например, применяемый в фотографии реактив Na 2 S 2 O 3 имеет название тиосульфат натрия). Происхождение этой приставки связано с греческим названием серы - theion.
Нахождение в природе
Сера довольно широко распространена в природе. В земной коре ее содержание оценивается в 0,05% по массе. В природе часто встречаются значительные залежи самородной серы (обычно вблизи вулканов); в Европе они расположены на юге Италии, в Сицилии. Большие залежи самородной серы имеются в США (в штатах Луизиана и Техас), а также в Средней Азии, в Японии, в Мексике. В природе сера встречается как россыпями, так и в виде кристаллических пластов, иногда образуя изумительные по красоте группы полупрозрачных желтых кристаллов (так называемые друзы).
В вулканических местностях часто наблюдается выделение из-под земли газа сероводорода H 2 S; в этих же регионах сероводород встречается в растворенном виде в серных водах. Вулканические газы часто содержат также сернистый газ SO 2 .
На поверхности нашей планеты широко распространены месторождения различных сульфидных соединений. Наиболее часто среди них встречаются: железный колчедан (пирит (см.
ПИРИТ)
) FeS 2 , медный колчедан (халькопирит) CuFeS 2 , свинцовый блеск (см.
ГАЛЕНИТ)
PbS, киноварь (см.
КИНОВАРЬ)
HgS, сфалерит (см.
СФАЛЕРИТ)
ZnS и его кристалическая модификация вюртцит (см.
ВЮРТЦИТ)
, антимонит (см.
АНТИМОНИТ)
Sb 2 S 3 и другие. Известны также многочисленные месторождения различных сульфатов, например, сульфата кальция (гипс CaSO 4 ·2H 2 O и ангидрит CaSO 4), сульфата магния MgSO 4 (горькая соль), сульфата бария BaSO 4 (барит), сульфата стронция SrSO 4 (целестин), сульфата натрия Na 2 SO 4 ·10H 2 O (мирабилит) и др.
Каменные угли содержат в среднем 1,0-1,5% серы. Сера может входить и в состав нефти. Целый ряд месторождений природного горючего газа (например, Астраханское) содержат как примесь сероводород.
Сера относится к элементам, которые необходимы для живых организмов, так как она является существенной составной частью белков. Белки содержат 0,8-2,4% (по массе) химически связанной серы. Растения получают серу из сульфатов, содержащихся в почве. Неприятные запахи, возникающие при гниении трупов животных, объясняются главным образом выделением соединений серы (сероводорода и меркаптанов (см.
ТИОЛЫ)
), образующихся при разложении белков. В морской воде присутствует около 8,7·10 -2 % серы.
Получение
Серу получают, в основном, выплавляя ее из горных пород, содержащих самородную (элементарную) серу. Так называемый геотехнологический способ позволяет получать серу без подъема руды на поверхность. Этот способ был предложен в конце 19 в. американским химиком Г. Фрашем, перед которым встала задача извлечения на поверхность земли серы из месторождений юга США, где песчаный грунт резко усложнял ее добычу традиционным шахтным методом.
Фраш предложил использовать для подъема серы на поверхность перегретый водяной пар. Перегретый пар по трубе подают в подземный слой, содержащий серу. Сера плавится (ее температура плавления немного ниже 120°С) и по трубе, расположенной внутри той, по которой под землю закачивают водяной пар, поднимается наверх. Для того, чтобы обеспечить подъем жидкой серы, через самую тонкую внутреннюю трубу нагнетают сжатый воздух.
По другому (термическому) методу, получившему особое распространение в начале 20 в. на Сицилии, серу выплавляют, или возгоняют, из дробленной горной породы в специальных глиняных печах.
Существуют и другие методы выделения самородной серы из породы, например, экстракцией сероуглеродом или флотационными методами.
В связи с тем, что потребность промышленности в сере очень велика, разработаны методы ее получения из сероводорода H 2 S и сульфатов.
Метод окисления сероводорода до элементарной серы был впервые разработан в Великобритании, где значительные количества серы научились получать из остающегося после получении соды Na 2 CO 3 по методу французского химика Н. Леблана (см.
ЛЕБЛАН Никола)
сульфида кальция CaS. Метод Леблана основан на восстановлении сульфата натрия углем в присутствии известняка CaCO 3 .
Na 2 SO 4 + 2C = Na 2 S + 2CO 2 ;
Na 2 S + CaCO 3 = Na 2 CO 3 + CaS.
Соду затем выщелачивают водой, а водную суспензию плохо растворимого сульфида кальция обрабатывают диоксидом углерода:
CaS + CO 2 + H 2 O = CaCO 3 + H 2 S
Образующийся сероводород H 2 S в смеси с воздухом пропускают в печи над слоем катализатора. При этом за счет неполного окисления сероводорода образуется сера:
2H 2 S + O 2 = 2H 2 O +2S
Аналогичный метод используют для получения элементарной серы и из сероводорода, сопутствующего природным газам.
Так как современная техника нуждается в сере высокой чистоты, разработаны эффективные методы рафинирования серы. При этом используют, в частности, различия в химическом поведении серы и примесей. Так, мышьяк и селен удаляют, обработав серу смесью азотной и серной кислот.
Использованием методов, основанных на дистилляции и ректификации, удается получить высокочистую серу с содержанием примесей 10 –5 –10 –6 % по массе.
Физические и химические свойства
Атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S–S составляет около 260 кДж/моль). Гомоцепи серы имеют зигзагообразную форму, так как в их образовании принимают участие электроны, расположенные в соседних атомах на взаимно перпендикулярных р-орбиталях. Эти цепи могут достигать большой длины, или, наоборот, образовывать замкнутые кольца S 20 , S 8 , S 6 , S 4 .
Поэтому сера образует несколько десятков как кристаллических, так и аморфных модификаций, отличающихся как составом молекул и полимерных цепей, так и способом их упаковки в твердом состоянии.
При нормальном давлении и температурах до 98,38 °C стабильна a-модификация серы (иначе эту модификацию называют ромбической), образующая лимонно-желтые кристаллы. Ее кристаллическая решетка орторомбическая, параметры элементарной ячейки a = 1,04646, b = 1,28660, c = 2,4486 нм. Плотность 2,07 кг/дм 3 . Выше 95,39 °C стабильна b -модификация серы (так называемая моноклинная сера). При комнатной температуре параметры элементарной ячейки моноклинной b-S a = 1.090, b = 1.096, c = 1,102 нм, t = 83,27 °С. Плотность b-S 1,96 кг/дм 3 .
В структурах как a-, так и b-модификаций серы имеются неплоские восьмичленные циклические молекулы S 8 . Такие молекулы немного похожи на короны.
Две эти модификации серы отличаются взаимной ориентацией молекул S 8 в кристаллической решетке.
Еще одну модификацию серы - так называемую ромбоэдрическую серу - можно получить выливанием раствора тиосульфата натрия Na 2 S 2 O 3 в концентрированную соляную кислоту при 0 °C с последующей экстракцией серы толуолом (см.
ТОЛУОЛ)
. После испарения растворителя возникают ромбоэдрические кристаллы, содержащие молекулы S 6 в форме кресла.
Аморфную серу (плотность 1,92 г/см 3) и резиноподобную пластическую серу получают при резком охлаждении расплавленной серы (выливая расплав в холодную воду). Эти модификации состоят из нерегулярных зигзагообразных цепей S n . При длительном выдерживании при температурах 20-95 °C все модификации серы превращаются в a-серу.
Температура плавления ромбической a -серы 112,8 °С, а моноклинной b-серы 119,3 °С. И в том, и в другом случае образуется легкоподвижная желтая жидкость, которая при температуре около 160 °С темнеет; ее вязкость повышается, и при температуре выше 200 °С расплавленная сера становится темно-коричневой и вязкой, как смола. Это объясняется тем, что сначала в расплаве разрушаются кольцевые молекулы S 8 . Возникающие фрагменты объединяются друг с другом с образованием длинных цепей S µ из нескольких сотен тысяч атомов. Дальнейшее нагревание расплавленной серы (выше температуры 250 °C) ведет к частичному разрыву цепей, и жидкость снова становится более подвижной. На рис. показана температурная зависимость вязкости жидкой серы. Около 190 °C ее вязкость примерно в 9000 раз больше, чем при 160 °C.
При температуре 444,6 °C расплавленная сера закипает. В зависимости от температуры в ее парах можно обнаружить молекулы S 8 , S 6 , S 4 и S 2 . Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого цвета. При температуре выше 1500 °C молекулы S 2 диссоциируют на атомы.
Молекулы S 2 парамагнитны (см.
ПАРАМАГНЕТИК)
и построены аналогично молекуле O 2 . Во всех других состояниях сера диамагнитна (см.
ДИАМАГНЕТИК)
.
В воде сера практически нерастворима. Некоторые ее модификации растворяются в органических жидкостях (толуоле, бензоле) и особенно хорошо - в сероуглероде CS 2 и жидком аммиаке NH 3 .
Сера - достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами.
S + O 2 = SO 2 , S + 3F 2 = SF 6 ,
2S + Cl 2 = S 2 Cl 2 (c примесью SCl 2)
С водородом при нагревании сера образует сероводород H 2 S и в небольшом количестве сульфаны (соединения состава H 2 S n):
H 2 + S H 2 S.
Примеры реакций серы с металлами:
2Na + S = Na 2 S, Ca + S = CaS, Fe + S = FeS
Образующиеся в этих реакциях сульфиды характеризуются не постоянным, а, как правило, переменным составом. Так, состав сульфида кальция может непрерывно изменяться в границах от CaS до CaS 5 . Полисульфиды типа СаS n или Na 2 S n при взаимодействии, например, с соляной кислотой образуют сульфаны H 2 S n
, причем значение n может составлять от 1 до приблизительно 10.
Концентрированная серная кислота при нагревании окисляет серу до SO 2:
S + 2H 2 SO 4 = 2H 2 O + 3SO 2 .
Царская водка (смесь азотной и соляной кислот) окисляет серу до серной кислоты.
Разбавленная азотная кислота, соляная кислота без окислителей и серная кислота на холоде с серой во взаимодействие не вступают. При нагревании в кипящей воде или растворах щелочей сера диспропорционирует:
3S + 6NaOH 2Na 2 S + Na 2 SO 3 + 3H 2 O;
Сера может присоединяться к сульфидам
Na 2 S + (n–1)S = Na 2 S n
и к сульфитам:
Na 2 SO 3 + S = Na 2 S 2 O 3
В результате протекания данной реакции из сульфита натрия Na 2 SO 3 образуется тиосульфат натрия Na 2 S 2 O 3 .
При нагревании сера реагирует почти со всеми элементами, кроме инертных газов, иода, азота, платины и золота.
Известно несколько оксидов серы. Кроме устойчивых диоксида серы SO 2 [другие названия: сернистый газ, сернистый ангидрид, оксид серы (IV)] и триоксида серы SO 3 [другие названия: серный газ, серный ангидрид, оксид серы (VI)], получены неустойчивые оксиды S 2 O (при пропускании тока SO 2 через тлеющий разряд) и S 8 O (при взаимодействии H 2 S c SOCl 2). Пероксиды SO 4 и S 2 O 7 образуются при пропускании SO 2 в смеси с кислородом через тлеющий разряд или за счет окисления SO 2 озоном.
Кислотному диоксиду серы SO 2 соответствует неустойчивая кислота средней силы H 2 SO 3 (сернистая кислота):
Н 2 О + SO 2 H 2 SO 3 ,
а кислотному триоксиду серы SO 3 - сильная двухосновная серная кислота (см.
СЕРНАЯ КИСЛОТА)
H 2 SO 4:
SO 3 + H 2 O = H 2 SO 4
И сернистой кислоте H 2 SO 3 , и серной H 2 SO 4 соответствуют по два ряда солей: кислые [соответственно гидросульфиты NaHSO 3 , Ca(HSO 3) 2 и др. и гидросульфаты КНSO 4 , NaНSO 4 и другие] и средние [сульфиты Na 2 SO 3 , K 2 SO 3 и сульфаты CaSO 4 , Fe 2 (SO 4) 3 ].
Сера входит в состав многих органических соединений (см. статьи Тиофен (см.
ТИОФЕН)
, Тиолы (см.
ТИОЛЫ)
и другие).
Применение
Около половины производимой серы используется на производство серной кислоты, около 25% расходуется для получения сульфитов, 10-15% - для борьбы с вредителями сельскохозяйственных культур (главным образом винограда и хлопчатника) (наибольшее значение здесь имеет раствор медного купороса CuSO 4 ·5H 2 O), около 10% используется резиновой промышленностью для вулканизации резины. Серу применяют при производстве красителей и пигментов, взрывчатых веществ (она до сих пор входит в состав пороха), искусственных волокон, люминофоров (см.
ЛЮМИНОФОРЫ)
. Серу используют при производстве спичек, так как она входит в состав, из которого изготовляют головки спичек. Серу до сих пор содержат некоторые мази, которыми лечат заболевания кожи. Для придания сталям особых свойств в них вводят небольшие добавки серы (хотя, как правило, примесь серы в сталях нежелательна).
Биологическая роль
Сера постоянно присутствует во всех живых организмах, являясь важным биогенным элементом (см.
БИОГЕННЫЕ ЭЛЕМЕНТЫ)
. Ее содержание в растениях составляет 0,3-1,2 %, в животных 0,5-2 % (морские организмы содержат больше серы, чем наземные). Биологическое значение серы определяется прежде всего тем, что она входит в состав аминокислот метионина (см.
МЕТИОНИН)
и цистеина (см.
ЦИСТЕИН)
и, следовательно, в состав пептидов (см.
ПЕПТИДЫ)
и белков. Дисульфидные связи –S–S– в полипетидных цепях участвуют в формировании пространственной структуры белков, а сульфгидрильные группы (–SH) играют важную роль в активных центрах ферментов. Кроме того, сера входит в молекулы гормонов, важных веществ. Много серы содержится в кератине волос, костях, нервной ткани. Неорганические соединения серы необходимы для минерального питания растений. Они служат субстратами окислительных реакций, осуществляемых распространенными в природе серобактериями (см.
СЕРОБАКТЕРИИ)
.
В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере - около 4.
Однако по своему отрицательному воздействию на окружающую среду и человека сера (точнее, ее соединения) стоит на одном из первых мест. Основной источник загрязнения серой - сжигание каменного угля и других видов топлива, содержащих серу. При этом около 96% серы, содержащейся в топливе, попадает в атмосферу в виде сернистого газа SO 2 .
В атмосфере сернистый газ постепенно окисляется до оксида серы (VI). Оба оксида - и оксид серы (IV), и оксид серы (VI) - взаимодействуют с парами воды с образованием кислотного раствора. Затем эти растворы выпадают в виде кислотных дождей. Оказавшись в почве, кислотные воды угнетают развитие почвенной фауны и растений. В результате создаются неблагоприятные условия для развития растительности, особенно в северных регионах, где к суровому климату добавляется химическое загрязнение. В результате гибнут леса, нарушается травяной покров, ухудшается состояние водоемов. Кислотные дожди разрушают изготовленные из мрамора и других материалов памятники, более того, они вызывают разрушение даже каменных зданий и изделий из металлов. Поэтому приходится принимать разнообразные меры по предотвращению попадания соединений серы из топлива в атмосферу. Для этого подвергают очистке от соединений серы нефть и нефтепродукты, очищают образующиеся при сжигании топлива газы.
Сама по себе сера в виде пыли раздражает слизистые оболочки, органы дыхания и может вызывать серьезные заболевания. ПДК серы в воздухе 0,07 мг/м 3 .
- сераль, я … Русское словесное ударение
Жен. одно из простых (несложных, неразлагаемых) веществ, плавкое и сильно горючее ископаемое вулканического рожденья; как товар, зовут ее: сера горючая. Порох делается из селитры и серы, с углем. Черенковая сера, отлитая палочками. | Сера, серка … Толковый словарь Даля
СЕРА - СЕРА, Sulfur, хим. элемент VІ гр. Менделеевской системы, символ S, порядковый номер 16, ат. в. 32,07. Известна с древнейших времен. В природе встречается в виде залежей водного (нептунического) и вулканического. происхождения. Встречается также в … Большая медицинская энциклопедия
СЕРА - хим. элемент, символ S (лат. Sulfur), ат. н. 16, ат. м. 32,06. Существует в виде нескольких аллотропных модификаций; среди них сера моноклинной модификации (плотность 1960 кг/м3, tпл = 119°С) и ромбическая сера (плотность 2070 кг/м3, ίπι = 112,8… … Большая политехническая энциклопедия
- (обозначается S), химический элемент VI группы ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ, неметалл, известный с древности. Встречается в природе как в виде отдельного элемента, так и в виде сульфидных минералов, таких как ГАЛЕНИТ и ПИРИТ, и сульфатных минералов,… … Научно-технический энциклопедический словарь
В мифологии ирландских кельтов Сера отец Парталона (см. глава 6). Согласно некоторым источникам, именно Сера, а не Парталон был мужем Дилгнейд. (
Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне серы содержится 6 электронов, которые имеют 3s 2 3p 4 . В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
 Нахождение серы в природе
Нахождение серы в природе
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS 2 - железный колчедан или пирит,
ZnS - цинковая обманка или сфалерит (вюрцит),
PbS - свинцовый блеск или галенит,
HgS - киноварь,
Sb 2 S 3 - антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропные модификации серы
Аллотропия
— это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О 2 и О 3 , S 2 и S 8 , Р 2 и Р 4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S 8 , образующие ромбическую и моноклинную серу. Это кристаллическая сера - хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
1) ромбическая — S 8
t°пл. = 113°C; r = 2,07 г/см 3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см 3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
Получение серы
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H 2 S + O 2 → 2S + 2H 2 O
- Реакция Вакенродера:
2H 2 S + SO 2 → 3S + 2H 2 O
Химические свойства серы
Окислительные свойства серы
(S
0
+ 2ē
→ S
-2
)
1) Сера реагирует со щелочными без нагревания:
S + O 2 – t° → S +4 O 2
2S + 3O 2 – t °; pt → 2S +6 O 3
4) (кроме йода):
S + Cl 2 → S +2 Cl 2
S + 3F 2 → SF 6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H 2 SO 4 (конц) → 3S +4 O 2 + 2H 2 O
S + 6HNO 3 (конц) → H 2 S +6 O 4 + 6NO 2 + 2H 2 O
Реакции диспропорционирования:
6) 3S 0 + 6KOH → K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O
7) сера растворяется в концентрированном растворе сульфита натрия:
S 0 + Na 2 S +4 O 3 → Na 2 S 2 O 3 тиосульфат натрия


Так как сера встречается в природе в самородном состоянии, она была известна человеку уже в глубокой древности. Большое внимание уделяли сере алхимики. Многим из них была уже известна серная кислота. Василий Валентин в XV в. подробно описал ее получение (нагреванием железного купороса). Фабричным способом серная кислота была получена впервые в Англии в середине XVIII в.
Нахождение в природе, получение:
В природе часто встречаются значительные залежи серы (большей частью вблизи вулканов). Наиболее часто встречающиеся сульфиды: железный колчедан (пирит) FeS 2 , медный колчедан CuFeS 2 , свинцовый блеск PbS и цинковая обманка ZnS. Еще чаще сера встречается в виде сульфатов, например сульфат кальция (гипс и ангидрит), сульфат магния (горькая соль и кизерит), сульфат бария (тяжелый шпат), сульфат стронция (целестин), сульфат натрия (глауберова соль).
Получение.
1. Выплавление самородной серы из природных залежей, например с помощью водяного пара, и очистка сырой серы перегонкой.
2. Выделение серы при десульфурации продуктов газификации угля (водяной, воздушный и светильный газы), например, под действием воздуха и катализатора-активного угля:
2H 2 S + O 2 = 2H 2 O + 2S
3. Выделение серы при неполном сгорании сероводорода (уравнение см. выше), при подкислении раствора тиосульфата натрия:
Na 2 S 2 O 3 +2HCI = 2NaCI + SO 2 + H 2 O + S
и при перегонке раствора полисульфида аммония:
(NH 4) 2 S 5 =(NH 4) 2 S + 4S
Физические свойства:
Сера - твердое хрупкое вещество желтого цвета. В воде практически нерастворима, но хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций. ???...
...
При 444,6°С сера кипит, образуя пары темно-бурого цвета.
Химические свойства:
Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два электрона и проявлять степень окисления -2. При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть +2, +4 и +6.
Сера при сгорании на воздухе или в кислороде образуется оксид серы (IV) SO 2 и частично оксид серы(VI) SO 3 . При нагревании непосредственно соединяется с водородом, галогенами (кроме иода), фосфором, углем, а также со всеми металлами, кроме золота, платины и иридия. Например:
S + H 2 = H 2 S; 3S + 2P = P 2 S 3 ; S + CI 2 = SCI 2 ; 2S + C = CS 2 ; S + Fe = FeS
Как следует из примеров, в реакциях с металлами и некоторыми неметаллами сера является окислителем, в реакциях же с более активными неметаллами, как например, с кислородом, хлором, - восстановителем.
По отношению к кислотам и щелочам...
...
Важнейшие соединения:
Диоксид серы
, SO 2 - бесцветный, тяжелый газ с острым запахом, очень легко растворяется в воде. В растворе SO 2 легко окисляется.
Сернистая кислота
, H 2 SO 3: двухосновная кислота, ее соли называются сульфиты. Сернистая кислота и ее соли являются сильными восстановителями.
Триоксид серы
, SO 3: бесцветная жидкость, очень сильно поглощает влагу образуя серную кислоту. Обладает свойствами кислотных оксидов.
Серная кислота
, H 2 SO 4: очень сильная двухосновная кислота уже при умеренном разбавление практически полностью диссоциирует на ионы. Серная кислота малолетуча и вытесняет многие другие кислоты из их солей. Образующиеся соли называются сульфатами, кристаллогидраты - купоросами. (например, медный купорос CuSO 4 *5H 2 O, образует кристаллы голубого цвета).
Сероводород
, H 2 S: бесцветный газ с запахом гнилых яиц, Ткип = - 61°С. Одна из самых слабых кислот. Соли - сульфиды
...
...
...
Применение:
Сера широко применяется в промышленности и сельском хозяйстве. Около половины ее добычи расходуется для получения серной кислоты. Используют серу для вулканизации каучука. В виде серного цвета (тонкого порошка) сера применяется для борьбы с болезнями виноградника и хлопчатника. Она употребляется для получения пороха, спичек, светящихся составов. В медицине приготовляют серные мази для лечения кожных заболеваний.
Мякишева Е.А.
ХФ ТюмГУ, 561 гр.
Источники:
1. Химия: Справ. Изд./В. Шретер. – М.: Химия, 1989.
2. Г.Реми «Курс неорганической химии» - М.: Химия,1972.