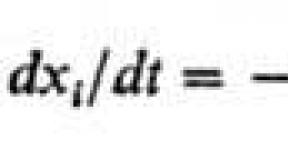Нахождение ph раствора соли. Методика расчёта pH в растворах средних гидролизующихся солей. Вопросы для самоконтроля
1.Расчет рН в растворах сильных кислот и оснований.
Расчет рН в растворах сильных одноосновных кислот и оснований проводят по формулам:
рН = - lg C к и рН =14 + lg С о
Где C к, С о –молярная концентрация кислоты или основания, моль/л
2.Расчет рН в растворах слабых кислот и оснований
Расчет рН в растворах слабых одноосновных кислот и оснований проводят по формулам:рН = 1/2 (рК к – lgC к) и рН = 14 - 1/2(рК О - lg C О)
3.Расчет рН в растворах гидролизующихся солей
Различают 3 случая гидролиза солей:
а) гидролиз соли по аниону (соль образована слабой кислотой и сильным основанием, например CH 3 COO Na). Значение рН рассчитывают по формуле: рН = 7 + 1/2 рК к + 1/2 lg С с
б) гидролиз соли по катиону (соль образована слабым основанием и сильной кислотой, например NH 4 Cl).Расчет рН в таком растворе ведут по формуле: рН = 7 - 1/2 рК о - 1/2 lg С с
в) гидролиз соли по катиону и аниону (соль образована слабой кислотой и слабым основанием, например CH 3 COO NH 4). В этом случае расчет рН ведут по формуле:
рН = 7 + 1/2 рК к - 1/2 рК о
Если соль образована слабой многоосновной кислотой или слабым многопротонным основанием, то в перечисленные выше формулы (7-9) расчета рН подставляются значения рК к и рК о по последней ступени диссоциации
4.Расчет рН в растворах различных смесей кислот и оснований
При сливании кислоты и основания рН полученной смеси зависит от количеств взятой кислоты и основания и их силы.
4.Буферные системы
К буферным системам относятся смеси:
а)слабой кислоты и ее соли, напримерCH 3 COO H + CH 3 COO Na
б) слабого основания и его соли, например NH 4 OH + NH 4 Cl
в) смесь кислых солей разной кислотности, например NaH 2 PO 4 + Na 2 HPO 4
г) смесь кислой и средней солей, например NaНCO 3 + Na 2 CO 3
д) смесь основных солей разной основности, например Al(OH) 2 Cl + Al(OH)Cl 2 и т.д.
Расчет рН в буферных системах ведут по формулам: рН = рК к – lg C к /С с и рН = 14 – рК о + lg C о /С с
Кислотно-основные буферные растворы, уравнение Гендерсона-Хассельбаха. Общая характеристика. Принцип действия. Расчет рН буферного раствора. Буферная емкость.
Буферные растворы – системы, поддерживающие определенное значение какого-либо параметра (рН, потенциала системы и т.д.) при изменении состава системы.
Кислотно-основный называется буферный раствор , сохраняющий примерно постоянным значение рН при добавлении к нему не слишком больших количеств сильной кислоты или сильного основания, а также при разбавлении и концентрировании. Кислотно-основные буферные растворы содержат слабые кислоты и сопряженные с ним основания. Сильная кислота при добавлении к буферному раствору»превращается» в слабую кислоту, а сильное основание – в слабое основание. Формула для расчета рН буферного раствора: рН = рК о + lg C о /С с Это уравнение Гендерсона – Хассельбаха . Из этого уравнения следует, что рН буферного раствора зависит от соотношения концентраций слабой кислоты и сопряженного с ней основания. Поскольку при разбавлении это соотношение не изменяется, то и рН раствора остается постоянным. Разбавление не может быть безграничным. При очень значительном разбавлении рН раствора изменится, так как, во-первых, концентрации компонентов встанут настолько малыми, что уже нельзя будет пренебречь автопротолизом воды, а во-вторых, коэффициенты активности незаряженных и заряженных частиц по-разному зависят от ионной силы раствора.
Буферный раствор сохраняет постоянные величины рН при добавлении лишь не очень больших количеств сильной кислоты или сильного основания. Способность буферного раствора «сопротивляться» изменению рН зависит от соотношения концентраций слабой кислоты и сопряженного с ней основания, а также от их суммарной концентрации – и характеризуется буферной емкостью.
Буферная емкость – отношение бесконечно малого увеличения концентрации сильной кислоты или сильного основания в растворе(без изменения объема) в вызванному этим увеличением изменению рН(стр.239, 7.79)
В сильнокислой и сильнощелочной среде буферная емкость значительно увеличивается. Растворы, в которых достаточно высока концентрация сильной кислоты или сильного основания, также обладают буферными свойствами.
Буферная емкость максимальна при рН=рКа. Для поддержания некоторого значения рН следует использовать такой буферный раствор, у которого величина рКа входящий в его состав слабой кислоты находится как можно ближе к этому рН. Буферный раствор имеет смысл использовать для поддержания рН, находящегося в интервале рКа + _ 1 . Такой интервал называется рабочей силой буфера.
19.Основные понятия, связанные с комплексными соединениями. Классификация комплексных соединений. Константы равновесия, используемые для хар-ки комплексных соединений: константы образования, константы диссоциации (общие, ступенчатые, термодинамические, реальные и условные концентрационные)
Чаще всего комплексом называют частицу, образованную в рез-те донорно-акцепторного взаимодействия центрального атома(иона), называемого комплексообразователем, и заряженных или нейтральных частиц, называемых лигандами. Комплексообразователь и лиганды должны самостоятельно существовать в той среде, где происходит р-ция комплексообразования.
Комплексное соединение состоит из внутренней и внешней сфер. К3(Fe(CN)6)- К3-внешняя сфера, Fe-комплексообразователь, CN- лиганд, комплексообразователь+ лиганд=внутренняя сфера.
Дентатностью называется число донорных центров лиганда, участвующих в донорно-акцепторном взаимодействии при образовании комплексной частицы. Лиганды бывают монодентатными(Cl-, H2O, NH3), бидентатными(C2O4(2-), 1,10-фенантролин) и полидентатными.
Координационным числом называют число донорных центров лигандов, с которыми взаимодействует данный центральный атом. В выше указанном примере: 6-координационное число. (Ag(NH3)2)+ –координационное число 2, так как аммиак монодентатным лигандом, а в (Ag(S2O3)2)3- - координационное число 4, так как тиосульфат ион –бидентатный лиганд.
Классификация.
1)В зависимости от своего заряда: анионные((Fe(CN)6)3-), катионными((Zn(NH3)4)2 +) и незаряженными или комплексы-неэлектролиты(HgCl2).
2)В зависимости от числа атомов металла: моноядерные и полиядерные комплексы. В состав моноядерного комплекса входит один атом металла, а в состав полиядерного- два и более. Полиядерные комплексные частицы, содержащие одинаковые атомы металла, называют гомоядерными(Fe2(OH)2)4+ или Be3(OH)3)3+), а содержащие атомы различных металлов- гетероядерными(Zr2Al(OH)5)6+).
3)В зависимости от хар-ра лигандов: однороднолигандные и разнолигандные (смешаннолигандные) комплексы.
Хелаты-циклические комплексные соединения ионов металлов с полидентатными лигандами(обычно органическими), в которых центральный атом входит в состав одного или нескольких циклов.
Константы . Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости.
Если справочные данные по ступенчатым константам нестойкости отсутствуют, пользуются общей константой нестойкости комплексного иона:
Общая константа нестойкости равна произведению ступенчатых констант нестойкости.
В
аналитической химии вместо констант
нестойкости в последнее время пользуются
константами устойчивости комплексного
иона:

Константа устойчивости относится к процессу образования комплексного иона и равна обратной величине константы нестойкости: Куст = 1/Кнест.
Константа устойчивости характеризует равновесие образования комплекса.
Термодинамическая и концентрационная константы см. стр. 313.
20. Влияние различных факторов на процесс комплексообразования и устойчивость комплексных соединений. Влияние концентрации реагирующих в-в на комплексообразование. Расчет молярных долей свободных ионов металла и комплексов в равновесной смеси.
1)Устойчивость комплексных соединений зависит от природы комплексообразователя и лигандов. Закономерность изменения устойчивости многих комплексов металлов с различными лигандами можно объяснить с пом. Теории жестких и мягких кислот и оснований(ЖМКО): мягкие кислоты образуют более устойчивые соединения с мягкими основаниями, а жесткие- с жесткими.(напр., Al3+,B3+(ж. к-ты) образовывают комплексы с O- и N-сод. Лигандами(ж. основаниями), а Ag+ или Hg2+ (м. к-ты) с S-сод. Лигандами(м. осн.). Комплексы катионов металлов с полидентатными лигандами явл. Более устойчивыми, чем комплексы с аналогичными монодентатными лигандами.
2)ионная сила. При повышении ионной силы и уменьшения коэффициентов активности ионов устойчивость комплекса уменьшается.
3)температура. Если при образовании комплекса дельта Н больше 0, то при повышении температуры устойчивость комплекса увеличивается, если же дельта Н меньше 0, то уменьшается.
4)побочные р-ции. Влияние рН на устойчивость комплексов зависит от природы лиганда и центрального атома. Если в состав комплекса в качестве лиганда входит более или менее сильное основание, то при понижении рН происходит протонирование таких лигандов и уменьшение молярной доли формы лиганда, участвующей в образовании комплекса. Влияние рН будет тем сильнее, чем больше сила данного основания и чем меньше устойчивость комплекса.
5)концентрация. При возрастании концентрации лиганда увеличивается содержание комплексов с большим координационным числом и уменьшается концетрация свободных ионов металла. При избытке ионов металла в р-ре будет доминировать монолигандный комплекс.
Молярная доля ионов металла, не связанных в комплексы

Молярная доля комплексных частиц

Расчет активности ионов водорода по уравнениям закона действующих масс значительно упрощается, если брать отрицательные логарифмы входящих в эти уравнения величин. Введем следующие обозначения: а - активность, f - коэффициент активности, С - концентрация, К1 - первая и К2 - вторая константа диссоциации, Кш - константа диссоциации воды. Отрицательный десятичный логарифм активности ионов водорода обозначим рН.
Значения рС, рf, рК для различных концентраций, разной ионной силы и величины констант (рК) некоторых кислот и оснований приведены в табл. 1-3. Величина константы диссоциации воды и значения рКш ее при различных температурах приведены в табл. 4.




Пользуясь табл. 1-4, можно легко рассчитать значения рН некоторых растворов по следующим уравнениям (формулы 6-16):

Примеры расчетов по этим уравнениям приводим ниже. Для упрощения расчетов можно избежать вычислений ионной силы растворов для нахождения рf, приняв для одновалентных электролитов рf - 0,1, для двухвалентных рf - 0,2, для трехвалентных рf - 0,4; эти значения близки к показанным в табл. 3 при концентрациях, обычно применяемых в лабораторной практике (0,025-0,2 м.). В остальных случаях следует пользоваться данными табл. 3. При более приближенных расчетах можно совсем не учитывать поправку на рf.

При пользовании уравнениями (8)-(16) поправку на рf следует учитывать только в том случае, если при расчете используется значение концентрационной константы диссоциации (в табл. 2 эти константы не подчеркнуты).
Вывод уравнений (6)-(16) здесь не приводится; его можно найти в учебниках физической химии.
Сильные кислоты и основан и я - НСl, НNO3, НСlO4, H2SO4, КОН и др. Сильные кислоты и основания диссоциируют почти полностью. Поэтому активность ионов водорода растворов сильных кислот согласно (6) будет a = Cf, или в логарифмическом виде:
Для сильных оснований активность ионов водорода в растворах их может быть рассчитана из уравнения:
вывод которого легко может быть сделан с учетом равенств:
Слабые кислоты и основания - уксусная кислота, водные растворы аммиака, анилина и пр. Отрицательные логарифмы констант некоторых из них, или значения рК их, приведены в табл. 2.
По закону действующих масс для слабых кислот имеем:

Следует заметить, что при выводе уравнений (8) и (9) было принято, что концентрация недиссоциированной кислоты равна общей концентрации ее, или [НА]=С. Это приближенное равенство справедливо с точностью до 1 % только для кислот, константа диссоциации которых К равна или меньше 10в-3 или pК = 3. Таким образом, уравнениями (8) и (9) следует пользоваться для расчета рН кислот и оснований, для которых рК > 3. При рК меньше 3 следует пользоваться более сложными расчетами, которые здесь не приводятся.
Многоосновные слабые кислоты, имеющие две и более констант диссоциации - К1, К2, К3, и пр., например угольная, фосфорная, щавелевая и др. При расчете значения рН их растворов следует иметь в виду два случая: 1) между величинами первой и второй констант имеется существенная разница, так что рК2-рК1 > 3, и 2) величины первой и второй констант близки между собой, так что рК2-рK1 Во втором случае, т. е. когда рК2-рK1

Растворы солей. В зависимости от состава соли растворы их могут иметь щелочную, нейтральную или кислую реакцию. Поэтому при определении рН раствора их следует различать четыре случая: 1) соли, анион и катион которых принадлежат к сильному основанию и сильной кислоте; 2) соли, составленные слабой кислотой и сильным основанием; 3) соли, составленные сильной кислотой и слабым основанием; 4) соли, составленные слабой кислотой и слабым основанием.
Различная реакция водных растворов солей связана с разной степенью диссоциации сильных и слабых кислот и оснований. Выше было указано, что сильные электролиты диссоциируют в водных растворах полностью, а слабые - частично. Так как соли диссоциируют в водных растворах полностью, а слабые кислоты и основания частично, то при наличии в растворе анионов или катионов слабых кислот и оснований последние частично гидролизуются, переходят в сравнительно мало диссоциированные соединения, и в растворе появляется свободная сильная кислота или щелочь. Например, при растворении в воде соли NH4Cl (NH4 - катион слабого основания, Cl - анион сильной кислоты) происходит частичный гидролиз иона NH4 и переход его в сравнительно мало диссоциированное соединение NH4OH, а в растворе появляется свободная HCl:
Раствор такой соли будет кислым. Наоборот, при растворении в воде соли слабой кислоты и сильного основания по тем же причинам происходит подщелачивание раствора:
Очевидно, при расчете значения рН растворов солей следует учитывать степень диссоциации составляющих соль слабых кислот пли оснований или же величину констант диссоциации их.
1. Соли сильного основания и сильной кислоты: КСl, NaCl, KNO3 и др. Растворы этих солей должны иметь реакцию, близкую к нейтральной, так как ни анион, ни катион их не дают с водой малодиссоциированных соединений. Практически же в связи с ничтожной буферностью, присутствием загрязнений, а также растворенного углекислого газа растворы этих солей имеют значения рН, отличающиеся от 7 на величину до единицы и иногда даже более. Тщательная очистка солей перекристаллизацией и удаление из их растворов СO2 приближают реакцию растворов их к нейтральной.
2. Соли сильного основания и слабой кислоты - CH3COONa и др. В этом случае следует учитывать величину константы слабой кислоты, и величина рН растворов может быть вычислена по уравнению (11):

3. Соли слабого основания и сильной кислоты NH4Cl, NH4NO3, (NH4)2SO4 и др. Найти значение рН растворов этих солей можно по уравнению (12):
4. Соли слабого основания и слабой кислоты - CH3COONH4, NH4NO2 и др. Значение рН таких солей не зависит от концентрации их и может быть найдено по уравнению (13):

Кислые соли. Реакция кислых солей типа NaHCO3, КНСO3, кислый виннокислый калий [К(С4Н6О6)] и других в тех случаях, когда концентрация их в растворе превышает по меньшей степени в 100 раз величину первой константы диссоциации (т. е. при рK1-рK2), не зависит от концентрации и может быть вычислена по уравнению (14):

В тех случаях, когда концентрация кислой соли превышает величину первой константы (или второй константы для двузамещенных солей) меньше чем в 100 раз (или при pK1-рС
Расчет по этому уравнению осложняется тем, что до проведения его необходимо подсчитать величину суммы К1+С, а потом найти по табл. 1 значение р(K1+С). Величины констант диссоциации приведены в табл. 2. Например, для фосфорной кислоты K1=7,5 10в_3, или 0,0075. Тогда для 0,01 н. раствора получим: K1+С = 0,0075+0,01 =0,0175, a p(K1+C) = = 1,8.
Федеральное агентство по образованию РФ
Новгородский Государственный Университет им. Ярослава Мудрого
Кафедра химии и экологии
Водородный показатель
Гидролиз солей
Великий Новгород
Водородный показатель: Метод указ. / Сост. ; ; /
НовГУ им. Ярослава Мудрого, - Великий Новгород, 2012
Рассмотрены теоретические методы расчета и экспериментальные способы определения концентрации водородных ионов в растворах электролитов (рН растворов).
Методические указания предназначены для студентов всех специальностей, изучающих курс химии.
Утверждено на заседании кафедры химии и экологии НовГУ им. Ярослава Мудрого ……………….
Зав. кафедрой ХиЭ
ВВЕДЕНИЕ
Протекание различных химических процессов сильно зависит от реакции среды в растворе. Поэтому величина рН раствора является важнейшим показателем, который необходимо контролировать как при проведении реакций в научно-исследовательских лабораториях, так и в ходе разнообразных технологических процессов.
Настоящая лабораторная работа даёт возможность освоить способы измерения и методы расчёта рН в водных растворах электролитов. Перед её выполнением необходимо усвоить понятия: ионное произведение воды, характер среды, индикатор, гидролиз солей, водородный показатель.
I. ЦЕЛЬ РАБОТЫ
Изучить методы расчета рН растворов электролитов.
Освоить методы определения рН растворов.
2. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
2.1. Водородный показатель. Ионное произведение воды
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН.
Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр:
https://pandia.ru/text/80/203/images/image002_74.gif" width="134" height="31 src=">
Константа диссоциации при 22° С составляет
https://pandia.ru/text/80/203/images/image004_50.gif" width="370" height="33">
Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды и при 25° С составляет .
Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов если известна концентрация ионов ОН
и наоборот: https://pandia.ru/text/80/203/images/image010_29.gif" width="72" height="21">,эти концентрации (каждая из них) равны моль/л, т..gif" width="93" height="21 src="> и
рОН=-lg[ OH-]
Если >10https://pandia.ru/text/80/203/images/image015_26.gif" width="15" height="19 src=">моль/л -среда кислая; рН<7.
Если <10https://pandia.ru/text/80/203/images/image015_26.gif" width="15" height="19 src=">моль/л -среда щелочная; рН>7.
В любом водном растворе рН + рОН =14, где Биологическая хиимя" href="/text/category/biologicheskaya_hiimya/" rel="bookmark">биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
2.2 Вычисление рН растворов кислот и оснований.
Для вычисления рН растворов кислот и оснований следует предварительно вычислить молярную концентрацию свободных ионов водорода () или свободных гидроксил ионов (https://pandia.ru/text/80/203/images/image018_20.gif" width="75" height="21 src=">; рОН-=-lg[ OH-]; рН + рОН =14
Концентрация любого иона в моль/л в растворе электролита можно вычислить по уравнению
https://pandia.ru/text/80/203/images/image020_18.gif" width="13" height="13 src=">-степень диссоциации электролита;
n -количество ионов данного вида, которое получается при распаде одной молекулы электролита.
Если электролит слабый, то значение степени диссоциации может быть определено на основании закона разбавления Оствальда:
https://pandia.ru/text/80/203/images/image019_20.gif" width="120" height="24 src=">= √ СмКдис
Пример 1. Вычислить рН 0,001H раствора гидроксида натрия.
Решение: гидроксид натрия является сильным электролитом, диссоциация в водном растворе происходит по схеме:
https://pandia.ru/text/80/203/images/image008_33.gif" width="11" height="19">(моль/л) в растворе равна:
 |
Пример 2. Вычислить рН 1%-ного раствора муравьиной кислоты, считая, что плотность раствора равна 1г/мл; Кдисс =
Решение: 1л раствора содержит 10г НСООН, что составляет 10/46= =0,22моль, где 4б г/моль - молярная масса муравьиной кислоты. Следовательно, молярная концентрация раствора равна 0,22моль/л. Муравьиная кислота – слабый электролит, поэтому
https://pandia.ru/text/80/203/images/image026_17.gif" width="135" height="20 src=">,
https://pandia.ru/text/80/203/images/image014_29.gif" width="28" height="21"> и
[Н+] = 10-рН =10-4,3 = 5∙10-5моль/л; моль/л.
2.3. Реакция в растворах солей. Гидролиз.
Реакция водного раствора зависит не только от наличия в нем кислот или оснований, но также и от присутствия некоторых солей. Многие соли, растворяясь в воде, способны смещать реакцию среды в ту или иную сторону. При этом происходит
химическое взаимодействие между ионами соли и молекулами воды, сопровождающееся образованием слабых кислот или слабых оснований или малодиссоциируемых ионов. Эта реакция получила название гидролиза солей.
Гидролиз соли - это обратимый, обменный процесс взаимодействия ионов соли с водой, приводящий к образованию слабых электролитов. В результате гидролиза изменяется кислотность среды.
Рассмотрим наиболее типичные случаи гидролиза солей.
1. Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону).
В растворе накапливаются ионы, в результате чего реакция смещается в кислую сторону, рН в растворах солей подобного типа меньше7.
2. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону).
https://pandia.ru/text/80/203/images/image032_16.gif" width="28" height="20"> в растворе, среда щелочная, рН>7.
3. Соль, образованная слабой кислотой и слабым основанием (гидролиз по катиону и по аниону).
Аммоний" href="/text/category/ammonij/" rel="bookmark">аммония происходит образование двух слабых электролитов, раствор оказывается близким к нейтральному, рН~7.
4. Соль, образованная сильным основанием и сильной кислотой.
Соли подобного типа гидролизу не подвергаются..gif" width="28" height="20"> воды слабодиссоциируюших или труднорастворимых соединений, равновесие между ионами и молекулами воды не нарушается и раствор остается нейтральным, рН равен 7.
Особенности гидролиза солей, образованных слабыми многоосновными кислотами, а также солей, образованных слабыми многокислотными основаниями.
Гидролиз солей, образованных слабыми многоосновными кислотами, а также солей, образованных слабыми многоосновными основаниями, протекает ступенчато. В результате гидролиза по первой ступени образуются соответственно кислая или основная соль:
https://pandia.ru/text/80/203/images/image032_16.gif" width="28" height="20"> и препятствует дальнейшему протеканию гидролиза, и по второй ступени гидролиз практически не протекает.
2.4 Вычисление p H растворов солей
В качестве примера возьмем гидролиз ацетата натрия:
https://pandia.ru/text/80/203/images/image036_15.gif" width="207" height="23 src=">
Константа равновесия этой реакции
Так как концентрация воды практически остается постоянной, ее можно объединить с константой равновесия:
https://pandia.ru/text/80/203/images/image032_16.gif" width="28" height="20"> через ионное произведение воды [ и
подставив эту величину в уравнение Кг получаем
https://pandia.ru/text/80/203/images/image041_13.gif" width="32" height="19"> - константа диссоциации слабой кислоты.
В общем случае, если исходную концентрацию аниона слабой кислоты Аобозначить через С моль/л, то Ch моль/л – это концентрация той части аниона А, которая подверглась гидролизу и образовала Ch моль/л слабой кислоты HA и Ch моль/л гидроксильных ионов:
![]()
где: h – степень гидролиза, т.е доля молекул соли, подвергающихся гидролизу.
Константа гидролиза соли:
https://pandia.ru/text/80/203/images/image046_12.gif" width="52" height="23 src=">откуда .
Так как , то ![]()
Аналогично соотношение можно получить и при рассмотрении гидролиза соли слабого основания и сильной кислоты:
https://pandia.ru/text/80/203/images/image052_9.gif" width="172" height="41 src=">
Константа гидролиза определяется уравнением:
https://pandia.ru/text/80/203/images/image054_9.gif" width="33" height="20">- константа диссоциации слабого основания по 2-ой ступени.
Пример 4. Определить pH 0.02Н раствора соды Na2C03, учитывая только первую ступень гидролиза.
Решение: Гидролиз соли протекает по уравнению
https://pandia.ru/text/80/203/images/image056_8.gif" width="121" height="21">
Выполнение работ" href="/text/category/vipolnenie_rabot/" rel="bookmark">выполнении работ следует выполнять общие правила техники безопасности для химических лабораторий. При попадании реактивов на кожу или одежду пораженный участок необходимо быстро обильно промыть водой.
4. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт №1. Определение рН при помощи индикаторов.
Для проведения опыта на рабочем столе находятся 5 банок с растворами электролитов. Внесите в первую колонку таблицы1формулы этих пяти электролитов и во вторую колонку (данная) значения их концентрации. На одной банке не указана концентрация (во второй колонке поставить прочерк) – раствор этого электролита будет использоваться и в первом, и во втором опытах.
Определите окраску индикаторов в растворах указанных пяти электролитов .
а) Для этого налейте в пробирки по 1мл растворов и добавьте в каждую пробирку 1-2 капли фенолфталеина . Результаты наблюдений запишите в табл.1,используя данные Приложения (таблица 1). Пробирки хорошо помыть для продолжения опыта.
б) Опыт повторите с использованием индикатора метилового оранжевого . Результаты наблюдений также запишите в табл. 1.
в) Для приближенного определения рН раствора пользуются универсальной индикаторной бумагой , или универсальными индикаторами, представляющими собой смесь нескольких индикаторов с различными областями перехода. По прилагаемой к универсальной индикаторной бумаге цветной шкале устанавливают, при каких значениях рН индикаторная бумага окрашивается в тот или иной цвет.
Стеклянной палочкой (или пробкой) нанесите 2-3 капли исследуемого раствора на универсальную индикаторную бумагу, сравните окраску еще сырого пятна с цветной шкалой. Результаты наблюдений внесите в табл. 1
Таблица 1
Фор-мула элект-ролита | Концентрация электролита | Фенолфталеин | Метиловый оранжевый | Универсаль-ный индикатор | рН по показа-нию рН-метра | Кдис слабого электро-лита | Расчет-ное значение |
||||
Опыт 2. Потенциометрическое определение рН.
Опыт выполняется под руководством лаборанта.
В кювету налить раствор электролита с неизвестной концентрацией и погрузить в нее электроды. Перед погружением в контрольный раствор электроды надо тщательно промыть дистиллированной водой и удалить с поверхности избыток воды фильтровальной бумагой.
Отсчет величины рH по шкале прибора следует производить после того, как показания примут установившееся значение.
Результат измерения внести в табл. 1 (рН по показанию рН-метра) на других строках колонки поставить прочерки.
Сущность потенциометрического метода :
При погружении электрода в раствор между поверхностью шарика стеклянного (литиевого) электрода и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях замещаются ионами и стеклянный электрод приобретает свойства водородного электрода. Между поверхностью стекла и контрольным раствором возникает разность потенциалов ,величина которой определяется концентрацией ионов в растворе и температурой раствора:
https://pandia.ru/text/80/203/images/image060_8.gif" width="275" height="148">
1-полый шарик из электродного (литиевого) стекла;
2-стеклянный электрод;
3-внутренний контактный электрод;
4-вспомогательный электрод;
5-электролитический ключ;
6-пористая перегородка;
7-рН-метр рН-673.
Задание № 3.Теоретическое:
а) для раствора кислоты или основания с неизвестной концентрацией:
Написать уравнение электролитической диссоциации с учетом силы электролита;Для слабых электролитов в таблицу1 внести значения константы диссоциации(к1),
используя Приложение, таблица2;
- в растворе кислоты, используя значение рН по рН-метру, рассчитать концентрацию ионов водорода по формуле [Н+] = 10-рН;
-в растворе основания, используя значение рН по рН-метру, найти рОН=14-рН и сделать расчет концентрации гидроксид - ионов по формуле [ОН-] = 10-рОН;
Выразить из соответствующей формулы для расчета иона сильного или слабого электролита значение концентрации и сделать расчет.
б) для растворов кислот или оснований с известной концентрацией:
Написать уравнение электролитической диссоциации электролита. Указать обратим ли процесс для данного электролита;Для слабых электролитов в таблицу1 внести значения константы диссоциации(к1), используя Приложение, таблица2;
в) для раствора соли:
сделать перерасчет данной концентрации в молярную концентрацию. Плотность раствора принять равной 1г/мл;
Написать уравнение электролитической диссоциации электролита. Указать обратим ли процесс для данного электролита;
Написать молекулярные и ионно-молекулярные уравнения гидролиза по 1 ступени, указать по какому иону протекает гидролиз, кислотность среды и рН (< 7, > 7 или = 7);
Для слабых электролитов, ионы которых подвергаются гидролизу, в таблицу1 внести значения константы диссоциации по последней ступени(к, к2 или к3), используя Приложение, таблица2;
Сравнить расчетное значение с показаниями опыта1, сделать вывод.
г) основываясь на результатах наблюдения, сделайте вывод :
Можно ли с помощью фенолфталеина отличить: 1)кислую среду от нейтральной; 2)нейтральную от слабощелочной рН=8; 3) слабощелочную от умеренно щелочной рН=11?
Гидро́лиз (от др.-греч. ὕδωρ - вода и λύσις - разложение) - один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Гидролиз солей - разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов »).
Различают обратимый и необратимый гидролиз солей
· 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
(раствор имеет слабощелочную среду, реакция протекает обратимо
· 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
(раствор имеет слабокислую среду, реакция протекает обратимо , гидролиз по второй ступени протекает в ничтожной степени)
· 3. Гидролиз соли слабой кислоты и слабого основания:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью , так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза
Под степенью гидролиза
подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α
(или h гидр
);
α
= (c
гидр /c
общ)·100 %
где c
гидр - число молей гидролизованной соли, c
общ - общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза - константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В общем случае для соли, образованной слабой кислотой и сильным основанием:
![]() , где - константа диссоциации слабой кислоты, образующейся при гидролизе
, где - константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
![]() , где - константа диссоциации слабого основания, образующегося при гидролизе
, где - константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
![]()
Расчет pH:
Водоро́дный показа́тель , pH (произносится «пэ аш», английское произношение англ. pH - piː"eɪtʃ «Пи эйч») - мера активности (в очень разбавленных растворах она эквивалентна концентрации)ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
![]()
Вывод значения pH
В чистой воде при 25 °C концентрации ионов водорода () и гидроксид-ионов () одинаковы и составляют 10 −7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно · и составляет 10 −14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания - наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда > говорят, что раствор является кислым , а при > - щелочным .
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем - pH.
![]()
Несколько меньшее распространение получила обратная pH величина - показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH − :
как в любом водном растворе при 22 °C , очевидно, что при этой температуре.
Несмотря на то, что вода считается неэлектролитом, она частично диссоциирует с образованием катиона гидроксония и гидроксид-аниона:
H 2 O + H 2 O H 3 O + + OH -
Часто используют упрощенную форму записи данного процесса:
H 2 O H + + OH -
Это равновесие характеризуется соответствующей константой:
Поскольку в чистой воде и разбавленных водных растворах = const, данное выражение можно преобразовать к следующему виду:
K W =
Полученная константа называется ионным произведением воды. При 25 °С K W = 10 -14 . Отсюда следует, что в чистой воде и нейтральных растворах = = Ö10 -14 = 10 -7 . Очевидно, что в кислых растворах > 10 -7 , а в щелочных < 10 -7 . На практике часто пользуются показателем концентрации катионов водорода - отрицательным десятичным логарифмом (pH = -lg). В кислых растворах рН < 7, в щелочных pH > 7, в нейтральной среде pH = 7. Аналогично можно ввести гидроксильный показатель pOH = -lg. Водородный и гидроксильный показатели связаны простым соотношением: pH + pOH = 14.
Рассмотрим примеры расчета рН водных растворов сильных и слабых кислот.
Пример № 1. Сантимолярный раствор (0,01 моль/л) соляной кислоты (сильная одноосновная кислота).
HCl = H + + Cl -
C HCl = 0,01; pH = -lg 0,01 = 2
Пример № 2. Сантимолярный раствор (0,01 моль/л) гидроксида натрия (сильное однокислотное основание).
NaOH = Na + + OH -
C NaOH = 0,01; pOH = -lg 0,01 = 2;
pH = 14 - pOH = 12
Пример № 3. Сантимолярный раствор (0,01 моль/л) уксусной кислоты (слабая одноосновная кислота).
CH 3 COO - + H + CH 3 COOH
Из уравнения реакции следует, что = . Для слабого электролита » C. Подставим эти формулы в константу кислотной диссоциации уксусной кислоты и преобразуем полученное выражение:
![]() =
1,75×10 -5 ; ; »
=
1,75×10 -5 ; ; »
рН = - lg = -1/2(lgK a + lgC) = 1/2(pK a - lgC) = 1/2(4,75 + 2) = 3,38
Пример № 4. Сантимолярный раствор (0,01 моль/л) аммиака (гидроксид аммония, слабое однокислотное основание).
NH 3 + H 2 O NH 4 + + OH -
Из уравнения реакции следует, что = . Так как гидроксид аммония слабый электролит, то » C. Подставив эти формулы в константу ионизации аммиака как основания, получим:
![]() =
1,8×10 -5 ; ; =
=
1,8×10 -5 ; ; =
рOН = -lg = 1/2(pK b - lgC);
pH = 14 - pOH = 14 + 1/2(lgC - pK b) = 14 + 1/2(-2 - 4,76) = 10,62
Гидролиз солей . Отличие кислотности водных растворов солей от кислотности чистой воды определяется их гидролизом. Гидролиз - это обменное взаимодействие растворенного вещества с водой . По склонности к гидролизу соли делятся на четыре типа:
1. Соли, образованные сильной кислотой и сильным основанием (например, NaCl, Na 2 SO 4), гидролизу не подвергаются. Водные растворы таких солей имеют нейтральную реакцию (рН = 7).
2. Соли, образованные слабым основанием и слабой кислотой, гидролизуются в значительной степени и часто необратимо, например,
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ¯ + 3H 2 S
Кислотность их растворов определяется более растворимым веществом, и обычно близка к нейтральной (рН » 7).
3. Соли, образованные слабым основанием и сильной кислотой, гидролизуются обратимо, связывая гидроксид-анионы, и обуславливая кислую реакцию растворов (рН < 7). Например, гидролиз хлорида аммония можно описать следующими уравнениями:
NH 4 Cl + H 2 O NH 3 ×H 2 O + HCl
Из приведенных уравнений видно, что гидролизу подвергается не вся соль, а только ее катион. Катионы солей, образованных многокислотными слабыми основаниями, гидролизуются ступенчато, последовательно отщепляя от воды гидроксид-анионы:
Al 3+ + H 2 O Al(OH) 2+ + H +
Al(OH) 2+ + H 2 O Al(OH) 2 + + H +
Al(OH) 2 + + H 2 O Al(OH) 3 + H +
Суммарное уравнение гидролиза катиона алюминия имеет следующий вид:
Al 3+ + 3H 2 O Al(OH) 3 + 3H +
4. Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону, который отрывает от воды катион водорода. Освобождающиеся гидроксид-анионы придают раствору щелочную реакцию (pH > 7). Например, гидролиз ацетата натрия протекает следующим образом:
CH 3 COONa + H 2 O CH 3 COOH + NaOH
Очевидно, что гидролиз анионов солей слабых многоосновных кислот протекает ступенчато, например,
PO 4 3- + H 2 O HPO 4 2- + OH -
HPO 4 2- + H 2 O H 2 PO 4 - + OH -
H 2 PO 4 - + H 2 O H 3 PO 4 + OH -
Суммарное уравнение гидролиза фосфат-аниона имеет следующий вид
PO 4 3- + 3H 2 O H 3 PO 4 + 3OH -
Гидролизу подвергаются не только соли, но и ковалентные неорганические и органические соединения. Например:
PCl 3 + 3H 2 O = H 3 PO 3 + 3HCl

Важную роль в жизнедеятельности живых организмов играет гидролиз некоторых биомолекул - белков и полипептидов, жиров, а также полисахаридов.
Глубина протекания гидролиза характеризуется степенью гидролиза (h) - отношением количества вещества, подвергшегося гидролизу, к общему количеству вещества в растворе . Обратимый гидролиз может быть охарактеризован также константой. Например, для процесса гидролиза ацетат-аниона константа гидролиза записывается следующим образом:
![]()
Равновесная концентрация воды в выражение константы гидролиза не входит, поскольку она постоянна и автоматически переносится в левую часть равенства.
Расчет константы и степени гидролиза, а также рНводных растворов солей рассмотрим на конкретных примерах.
Пример № 5. Сантимолярный раствор (0,01 моль/л) хлорида аммония (соль, образованная слабым основанием и сильной кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
NH 4 + + H 2 O NH 3 ×H 2 O + H +
![]()
Умножив числитель и знаменатель правой части равенства на концентрацию гидроксид-ионов, константу гидролиза можно преобразовать следующим образом:
![]() = 5,56×10 -10
= 5,56×10 -10
Из уравнения гидролиза следует, что = = Ch, а = C - Ch = C(1-h). Соответственно,
![]()
Так как h << 1, а (1-h) ® 1, полученное выражение можно упростить:
; отсюда h »
![]() » 2,36×10 -4 или 0,0236%
» 2,36×10 -4 или 0,0236%
Из полученных уравнений видно, что константа и степень гидролиза соли увеличиваются с уменьшением константы диссоциации основания, т.е. с уменьшением его силы. Кроме этого, степень гидролиза и глубина его протекания увеличивается с уменьшением концентрации (увеличением разбавления) соли. Константа гидролиза, как и константа любого равновесия, от концентрации не зависит. Увеличение температуры приводит к увеличению степени и константы гидролиза, поскольку гидролиз - процесс эндотермический.
При расчете величины рН раствора соли учтем, что = , а в первом приближении » C.
; отсюда »
pH = - lg = -1/2(lgK w + lgC + pK b) = 7 - 1/2(pK b + lgC) = 7 - 1/2(4,76 - 2) = 5,62
Пример № 6. Сантимолярный раствор (0,01 моль/л) ацетата натрия (соль, образованная сильным основанием и слабой кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
CH 3 COO - + H 2 O CH 3 COOH + OH -
![]()
Умножив числитель и знаменатель правой части равенства на концентрацию катиона водорода, его можно преобразовать к следующему виду:
![]() = 1×10 -14 /1,75×10 -5 = 5,71×10 -10
= 1×10 -14 /1,75×10 -5 = 5,71×10 -10
Из уравнения гидролиза следует, что = = Ch, а = C - Ch = C(1-h).
Соответственно,
![]() ; ; отсюда h =
; ; отсюда h =