Презентация волшебная соль. Соли презентация к уроку на тему Как скачать презентацию про соль
Соли
Выполнила: Семёнова Елена Сергеевна КГУ «школа-лицей № 4 акимата
г. Рудного»

1). Определение. Формулы.
2). Классификация.
3). Способы получения.
4). Физические свойства.
5). Химические свойства.
6). Применение.
7). Вопросы для повторения.

Определение. Формулы.
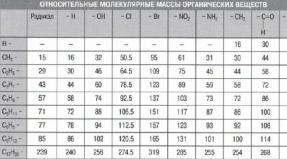
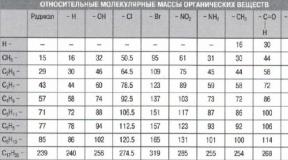
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
название
Кислотный
Хлороводо –
формула
остаток
Соль
родная или соляная
Серная
Азотная
формула
Угольная
название
Фосфорная
Хлорид
Н2СО3
натрия
Н3РО4
Кремниевая
Сульфат Са
СаСО3
Нитрат Na
К3РО4
Карбонат Са
Фосфат К
Силикат Na

- Соли соляной кислоты НСl - хлориды
- Соли серной кислоты H 2 SO 4 - сульфаты
- Соли азотной кислоты HNO 3 - нитраты
- Соли угольной кислоты Н 2 СО 3 - карбонаты
- Соли фосфорной кислоты Н 3 РО 4 - фосфаты
- Соли кремниевой кислоты H 2 SiO 3 – силикаты
- Соли сероводородной кислоты Н 2 S – сульфиды
- Соли сернистой кислоты H 2 SO 3 - сульфиты

Классификация
Соли
средние кислые основные двойные
или
нормальные
Na 3 PO 4 KHSO 4 Mg(OH)Cl K 2 NaPO 4
K 2 SO 4 NaH 2 PO 4

Средними или нормальными солями – называют соли, которые образуются при замещении атомами металлов всех атомов водорода в молекулах кислот:
H 3 PO 4 + 3NaOH Na 3 PO 4 + 3H 2 O
Кислыми солями называют соли, которые образуются в результате неполного замещения атомами металлов атомов водорода в молекулах кислот (получаются при избытке кислоты):
H 3 PO 4 + NaOH NaH 2 PO 4 + H 2 O

Основными солями называют соли, в молекулах которых, кроме кислотных остатков, имеются также гидроксогруппы (получаются при избытке оснований):
Mg(OH) 2 + HCl Mg(OH)Cl + H 2 O
Двойными солями называют соли, которые образуются при замещении атомов водорода в молекулах кислот двумя различными металлами:
H 3 PO 4 + 2KOH + NaOH K 2 NaPO 4 + 3H 2 O

Способы получения
1). Действие кислоты на металл:
2HCl + Zn ZnCl 2 + H 2
2). Взаимодействие кислоты и основного оксида:
H 2 SO 4 + CuO CuSO 4 + H 2 O
3). Взаимодействие кислоты и основания:
HNO 3 + KOH KNO 3 + H 2 O
4). Взаимодействие кислотного оксида со щёлочью:
N 2 O 5 + Ca(OH) 2 Ca(NO 3 ) 2 + H 2 O

5). Взаимодействие кислотного оксида с основным оксидом:
t
SiO 2 + CaO CaSiO 3
6). Взаимодействие соли с кислотой:
AgNO 3 + HCl AgCl + HNO 3
7). Взаимодействие соли со щёлочью:
FeCl 3 + 3KOH Fe(OH) 3 + 3KCl
8). Взаимодействие соли с металлом:
СuSO 4 + Fe FeSO 4 + Cu

9). Взаимодействие металла с неметаллом:
горение
2Fe + 3Cl 2 2FeCl 3
10). Взаимодействие двух солей:
Na 2 SO 4 + BaCl 2 BaSO 4 + 2NaCl

Взаимодействие хлора с железом Видео

Реакция обмена между оксидом меди (II) и серной кислотой Видео

Физические свойства
Соли – твёрдые вещества разного цвета с различной растворимостью в воде. Некоторые имеют различный запах и вкус.
Названия солей
Нитраты
Растворимость соответствующих солей
Хлориды
Все соли растворимы
Все соли растворимы, кроме AgCl и PbCl 2
Сульфаты
Сульфиды
Все соли растворимы, кроме CaSO 4 , SrSO 4 , BaSO 4, PbSO 4 и Ag 2 SO 4
Карбонаты
Силикаты
Фосфаты
Почти все соли нерастворимы, кроме
солей К, Na и аммония (соли, содержащие
группу NH 3 )

Химические свойства
1). Соли реагируют с металлами:
CuSO 4 + Fe FeSO 4 + Cu
Способность металлов вытеснять другой металл из его соли определяется положением металла в ряду активности: более активный металл вытесняет менее активный из его соли.
2). Соли реагируют с кислотами:
Pb(NO 3 ) 2 + 2HCl PbCl 2 + 2HNO 3

3). Соли реагируют со щелочами:
СuSO 4 + 2KOH Cu(OH) 2 + K 2 SO 4
4). Соли реагируют с солями:
CaCl 2 + Na 2 CO 3 CaCO 3 + 2NaCl
5). Некоторые соли при нагревании разлагаются:
t
СaCO 3 CaO + CO 2
6). Некоторые соли способны реагировать с водой и образовывать кристаллогидраты:
СuSO 4 + 5H 2 O = CuSO 4 5H 2 O + Q
белого цвета сине-голубого цвета

Взаимодействие металлов с солями Видео

Применение
1). В быту
2). В медицине
3). В промышленности:
- Фармацевтической
- Химической
- Кожевенной
- Текстильной
4). В сельском хозяйстве

Загадки
Я, конечно, очень нужен.
Без меня не сваришь ужин,
Не засолишь огурца,
Не заправишь холодца.
Но не только лишь в еде –
Я живу в морской воде.
Если льёт слеза из глаза,
Вкус припомнишь мой ты сразу.
Кто догадлив, говорит:
Это -
Нaтрия хлорид NaCl

В огне я воду испаряю,
В воде я камнем застываю;
Врачу и скульптору я брат,
Но чей, скажите, я сульфат?
Сообщаю: я спешу!
Я живу, пока пишу.
Исчертил всю доску белым…
Исчезаю. Был я …
Сульфат кальция - гипс CaSO4
Мелом СаСО3

Вопросы для повторения
1). Соли – это сложные вещества, образованные атомами и
2). Как называются соли соляной кислоты?
3). Назовите эту соль СаСО3 –
4). Какая кислота соответствует этой соли
Na2SiO3 ?
5). Формула нитрата алюминия –
6). Как называются соли угольной кислоты?
кислотными остатками
металлов
хлориды
карбонат кальция
кремниевая
Al(NO3)3
карбонаты
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
соли ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка. PO 4 Ион металла Кислотный остаток Ион металла Кислотный остаток Na Cl K 3
Классификация 1 . По составу кислотного остатка СОЛИ средние кислые Na 2 SO 4 K 3 PO 4 NaHSO 4 K 2 HPO 4
Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже М g С L 2 хлорид
Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в родительном падеже NaHSO 4 сульфат гидро натрия
Химические свойства 1. Взаимодействие с металлами: SnCl 2 + Zn ZnCl 2 + Sn
Химические свойства 2. Взаимодействие со щелочами: 2Na ОН + CuSO 4 → Cu(OH) 2 + Na 2 SO 4
Химические свойства 3. Взаимодействие солей между собой КС l + AgNO 3 → AgCl + KNO 3
Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO 2 CaCO 3 + HCl → CaCl 2 + H 2 CO 3 H 2 O
Химические свойства Разложение при нагревании СаСО 3 = СО 2 + Н 2 О
Способы получения 1. Кислота + основание = соль + вода H 2 SO 4 +2NaOH = Na 2 SO 4 + 2H 2 O 2. Кислота + металл = соль + водород 2HCL +Zn = ZnCL 2 + H 2 3. Кислота + основный оксид = соль + вода 2HCL + CuO = CuCL 2 + H 2 O 4. Кислота + соль = новая кислота + новая соль H 2 SO 4 + BaCL 2 = 2HCL + BaSO 4 Условия: в результате реакции должны получиться газ, осадок или вода. Основаны на химических свойствах оксидов, оснований, кислот 10 способов 10 способов 10 способов 10 способов 10 способов
Способы получения 5. Основание + соль = новое основание + новая соль 2 КОН + Са SO 4 = Са(ОН) 2 + К 2 SO 4 6. Основание + кислотный оксид + = соль + вода 2NaOH + SO 3 = Na 2 SO 4 + H 2 O 7. Кислотный оксид + основный оксид = соль СО 2 + СаО = СаСО 3 8. Соль + соль = новая соль + новая соль КС l + AgNO 3 → AgCl + KNO 3 9. Соль + металл = новая соль + металл CuSO 4 + Fe = FeSO 4 + Cu 10. Металл + неметалл = соль Fe + S = FeS 10 способов 10 способов 10 способов 10 способов
По теме: методические разработки, презентации и конспекты
Урок химии в 9 классе по программе О.С. Габриеляна с использованием занимательного опыта,карты пошаговых действий и тестирования как итога урока....
Химические свойства солей
Выполнила Егорова Ю.В., учитель химии и биологии МКОУ СОШ №4

- Дать понятие о солях как классе электролитов.
- Рассмотреть классификацию по составу.
- Охарактеризовать свойства солей в свете ионных представлений.

Соли – сложные вещества, состоящие из ионов металла и кислотного остатка.
Соли (с т.з. ТЭД ) – это электролиты, диссоциирующие на катион металла и анион кислотного остатка.

«Вода мертвого моря»
Na 2 SO 4 – сульфат натрия
NaCl – хлорид натрия
MgCl 2 – хлорид магния
KBr – бромид калия

Классификация солей
Основные
Средние
Кислые

Соли меди
Перманганаты

Задание 1
Новый железный бак, в котором приготовили раствор медного купороса для опрыскивания растений, прохудился. Объясните причину разрушения стенок бака.

Подсказка
- Я известно с давних пор
И имею спрос.
Опусти меня в раствор-
В медный купорос.
Изменить хочу я соль.
Ну –ка, выйди, соизволь.
Удивительный момент!
Стал другим раствор.
Вытесняю элемент,
Не вступая в спор.
На меня взгляни, ответь:
Что на мне осело?

Взаимодействие с металлами
СОЛЬ + МЕТАЛЛ → НОВАЯ СОЛЬ + НОВЫЙ МЕТАЛЛ
каждый предыдущий металл вытесняет менее активный металл из раствора соли
Mg + Fe Cl ₂ = MgCl₂ + Fe ↓

Взаимодействие с солями
соль1 +соль2= соль3↓+ соль4
Cu(NO ₃ ) ₂ + K₂S = 2KNO₃ + CuS↓

Задание 2
В некоторых городах из – за кислотных дождей разрушаются памятники архитектуры. Можно ли их спасти?

Подсказка
На земле живут три брата из семейства Карбонатов.
Старший брат – красавец мрамор,
Славен именем Карары,
Превосходный зодчий он
Строил Рим и Парфенон.
Всем известен известняк,
Потому и назван так.
Знаменит своим трудом,
Возводя за домом дом.
И способен, и умел
Младший мягкий братец мел.
Как рисует, посмотри,
Это ……….!

Взаимодействие с кислотами
соль₁ + кислота₁ → соль₂ + кислота₂
CO ₂
K ₂ CO ₃ + 2 HCl = 2KCl + H ₂ CO ₃
H ₂ O

Взаимодействие с щелочами
соль₁ + щелочь = соль₂ + основание↓
AlCl ₃ + 3KOH = 3KCl + Al(OH)₃↓

Задание 3
Царь зовет к себе Стрельца,
Удалого молодца,
И дает ему поручение
Государственного значения.
Чтоб я стал опять богат,
Нужен бария сульфат.
Ночь даю тебе подумать –
Утром буду ждать доклад!
Не смогешь – кого винить?
Должен я тебя казнить.
Запиши себе названье,
Чтоб со страху не забыть.
Получите возможными способами сульфат бария.

Д/З Пр. 41, упр. 2,3,4 (письменно)

Слайд 2
4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные оксиды)? Проверка домашнего задания
Слайд 3
К какому классу соединений относятся формулы веществ? Назовите их. H2SO4 Na2O Ba(OH)2 H2CO3 N2O5 KOH
Слайд 4
О каком веществе идёт речь?
У травоядных животных потребность в этом веществе велика. В тех странах, где этого вещества мало, люди прибегали к различным способам чтобы... Меланезийцы каждое утро пили морскую воду, в Новой Зеландии пищу запивали морской водой, в Северной Америке индейские племена высушивали морскую капусту и добавляли её в пищу.
Слайд 5
Научить составлять формулы солей и давать им названия; узнать классификацию, свойства солей, способы получения и применение солей. Цели урока:
Слайд 6
Задачи:
Научить находить среди неорганических веществ формулы солей; составлять формулы солей; называть соли.
Слайд 7
План урока:
6. Химические свойства. 1. Что такое соли? 2. Классификация солей. 3. Номенклатура солей. 4. Физические свойства. 5. Химические свойства. 6. Получение. 7. Применение. 8. Некоторые интересные факты.
Слайд 8
PO4 Ион металла Кислотный остаток Ион металла Кислотный остаток Na Cl K3 Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
Слайд 9
Найдите среди формул веществ-формулы солей
CO2H2 SO4CaO BaSO4K2SO4Fe(OH)3 HClMgCO3H2O
Слайд 10
Классификация солей
Слайд 11
Средние (нормальные) соли - все атомы водорода в молекулах кислоты замещены на атомы металла (KCl) Кислые соли - атомы водорода в кислоте замещены атомами металла частично (NaHCO3) Осно́вные соли - гидроксогруппы основания (OH−) частично замещены кислотными остатками. ((CuOH)2CO3)
Слайд 12
Двойные соли - в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами (KAl(SO4)2х12H2O) Смешанные соли - в их составе присутствует два различных аниона (Ca(OCl)Cl)
Слайд 13
Номенклатура средних солей
магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
Слайд 14
Номенклатура кислых солей
Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в родительном падеже NaHSO4 сульфат гидро натрия
Слайд 15
Номенклатура основных солей
Указать название кислотного остатка К названию кислотного остатка прибавить «основной-» Наименование металла в родительном падеже MgOHCl хлорид основной магния
Слайд 16
Номенклатура двойных солей
таллия (I) -натрия Название кислотного остатка Наименование металлов в родительном падеже NaTl(NO3)2 нитрат
Слайд 17
Номенклатура смешанных солей
кальция Название кислотных остатков Наименование металла в родительном падеже CaCLOCL хлорид-гипохлорит
Слайд 18
Составить формулы солей:
нитрита магния, силиката натрия, фосфата кальция.
Слайд 19
Физические свойства
Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета. По растворимости в воде соли делят (смотри таблицу растворимости): Нерастворимые CaCO3 Мел, мрамор, известняк Малорастворимые CaSO4 Безводный гипс
Слайд 20
Химические свойства
1. Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из раствора его соли. Fe + CuCI2=Cu + FeCI2Fe° + Cu²+ + 2CI = Cu° + Fe²+ +2CI-Fe° + Cu²+ = Cu° + Fe²+ или Fe° – 2e → Fe²+ │ процесс окисления (восстановитель) Cu²+ + 2e → Cu° │ процесс восстановления (окислитель)
Слайд 21
2. Взаимодействие со щелочами: В результате обязательно должно образоваться нерастворимое основание. 3. Взаимодействие солей между собой: 2NaОН +CuSO4 → Cu(OH)2 + Na2SO4 КСl + AgNO3 → AgCl + KNO3
Слайд 22
4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 +HCl → CaCl2 +H2CO3 H2O
Слайд 23
5. Разложение при нагревании: СаСО3= СО2 + Н2О
Слайд 24
Способы получения
1. Кислота + основание = соль + вода H2SO4 +2NaOH =Na2SO4 + 2H2O 2. Кислота + металл = соль + водород 2HCL +Zn = ZnCL2 + H2 3. Кислота + основный оксид = соль + вода 2HCL+CuO = CuCL2 + H2O 4. Кислота + соль = новая кислота + новая соль H2SO4+BaCL2 = 2HCL +BaSO4 Условия: в результате реакции должны получиться газ, осадок или вода. Основаны на химических свойствах оксидов, оснований, кислот
Слайд 25
Способы получения
5. Основание + соль = новое основание + новая соль 2КОН + СаSO4 = Са(ОН) 2 + К2SO4 6. Основание + кислотный оксид + = соль + вода 2NaOH + SO3 =Na2SO4 + H2O 7. Кислотный оксид + основный оксид = соль СО2+ СаО = СаСО3 8. Соль + соль = новая соль + новая соль КСl + AgNO3 → AgCl+ KNO3 9. Соль + металл = новая соль+ металл CuSO4+Fe= FeSO4+ Cu 10. Металл + неметалл = соль Fe +S = FeS
Слайд 26
Применение солей
Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия.Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Слайд 27
Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Слайд 28
Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
Слайд 29
Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.Карбонат натрия (соду) применяют в производстве стекла и при варке мыла.Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Слайд 30
О солиМёртвое море
Слайд 31
Розовое озеро в СенегалеЭто озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых. Местные женщины проводят до 14 часов в день собирая там соль.
Слайд 32
Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте около 3700 м. Его площадь составляет 10,5 квадратных километров. В центре толщина соли достигает 10 метров. Это озеро содержит более 10 миллиардов тонн соли. Когда Salar de Uyuni покрывается водой, в нем отражается каждое облако.
Слайд 33
Химический диктант
1 вариант 1.соли металла 2. сульфат алюминия 3. белого 4. Cu(OH)2 5. хлора, соды 2 вариант 1. ионов металла и кислотного остатка. 2. нитрат кальция. 3.растворимые, нерастворимые и малорастворимые. 4. CаCL2 5. калийное Критерии оценки 5 правильных ответов - «5» 4 правильных ответов - «4» 3 правильных ответов - «3» Меньше 3 правильных ответов - «2»
Слайд 37
СПАСИБО ЗА УРОК!
Слайд 38
Список используемых источников
Рудзитис Г.Е. Химия. Неорганическая химия. 8 класс: Учебник для общеобразовательных учреждений с прил. на электрон. носителе: базовый уровень. Просвещение, 2011 – 176 с. Журнал Химия в школе №7. 2012 год [стр. 24-25]; Дидактический и раздаточный материал. Издательство «Учитель», 2012 http://school-collection.edu.ru/collection/organic/ http://ru.wikipedia.org/wiki/ http://www.chemnet.ru http://www.hij.ru http://him-school.ru www.bfnm.ru
Посмотреть все слайды
1 слайд

2 слайд
"Среди всех природных минеральных солей, самая главная та, которую мы называем просто “соль”. А.Е.Ферсман

3 слайд

4 слайд
Слово “соль” произошло от латинского слова “sal”, которое происходит от греческого термина “hals” - означающего “море”.

5 слайд
Латинское слово "salarium" и английское слово "salary", означающие "жалованье", "зарплата", - имеют "солевое" происхождение.

6 слайд
Римским солдатам выдавали разрешение на покупку соли salarium argentum, от которого произошло английское слово salary (заработная плата).

7 слайд
Иногда римским солдатам выдавали жалование солью, а также «сольдо» - монетой, жалованьем, которое воины получали в обмен за готовность проливать кровь – отсюда произошло и русское слово – солдат.

8 слайд
Также римляне предпочитали солить зелень, в результате чего латинское слово, обозначающее соль, вошло в состав нового слова salad (салат)

9 слайд
Древнегреческий поэт Гомер назвал поваренную соль «божественной». В те далекие времена она ценилась выше золота. Из-за месторождений соли происходили военные столкновения, а нехватка соли у населения вызывала «соляные бунты». М. В. Ломоносов писал, что в его время за четыре-пять плиток соли можно было купить раба. Многие племена в Центральной Африке отдавали за чашку соли чашку золота. В Китае XIII века из каменной соли делали монеты.

10 слайд
Поваренная соль известна человеку с незапамятных времен, и название ее сходно во многих языках. В честь соли названы многие города, реки и озера: Солигалич, Соликамск, Сольвычегорск, Соль-Илецк, Сольцы, Усолье и Усолье-Сибирское; реки - Усолка и Соленая и многие другие.

11 слайд
Хлори д на трия - химическое соединение NaCl, натриевая соль соляной кислоты. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).

12 слайд
к р и с т а л л ы г а л и т а Галит - каменная (поваренная) соль, минерал подкласса хлоридов, кристаллическая форма хлорида натрия (NaCl).

13 слайд
Хлорид натрия (масштабная модель) Хлорид натрия (шаростержневая модель) Кристаллическая решётка хлорида натрия NaCl

14 слайд
Поваренная соль кристаллизуется в форме куба. Куб – правильный многогранник, октаэдр, вершин - 8, ребер - 12, граней – 6. Ионы натрия Na+ и хлора Cl-в узлах кристаллической решётки поваренной соли определяют кубическую форму кристаллов. Кристаллическая решётка хлорида натрия называется ионной кристаллической решёткой.

15 слайд

16 слайд
Крупные кристаллы поваренной соли выставляются в минералогических музеях 100-килограммовый кристалл

17 слайд

18 слайд
В 1960- е годы поваренную соль - хлорид натрия - окрестили "белой смертью", и это пугающее название тянется до сих пор, переходя из поколения в поколение. Это несправедливо и неверно. Конечно, злоупотреблением солью запросто можно загубить сердечно-сосудистую и мочевыделительную системы и преждевременно свести себя в могилу. Но это относится к злоупотреблению любым продуктом.

19 слайд
Соль – обязательная составная часть организма человека. Соль поддерживает нормальную деятельность клеток, из которых состоят все ткани и органы. Из соли в желудке вырабатывается соляная кислота, без которой невозможно переваривание пищи. Суточная потребность в поваренной соли для взрослого человека составляет 10 – 15 грамм.

20 слайд
Есть поговорка: «Чтобы хорошо узнать человека, надо съесть с ним пуд соли». Оказывается, это можно сделать всего за год с небольшим. Ведь потребность соли для нормального питания человека составляет не менее 7 килограммов в год.

21 слайд
Без соли невозможно существование организма млекопитающих. Все биологические жидкости - кровь, пот, моча, слюна, слеза, мокрота - содержат ионы натрия и хлора. Основная роль хлорида натрия - это поддержание осмотического давления и постоянства объема жидкости. Натрий и хлор также участвуют в пищеварении (без соляной кислоты пища в желудке не переварится).

22 слайд
стимулирует обмен веществ; стимулирует рост волос; придает бодрость и силу; входит в состав желудочного сока (в виде 0,2 % соляной кислоты). Cl- ВНИМАНИЕ! Без соляной кислоты практически прекращается процесс переваривания пищи.

23 слайд
Na+ ион натрия – главный внеклеточный ион; содержится в крови и лимфе; вместе с ионами калия обеспечивает: 1. Проницаемость клеточных мембран для различных веществ. 2. Проведение импульса по нервному волокну. 3. Регулирует давление крови в организме.

24 слайд
Соль для организма жизненно нужна. Почему? Чтобы ответить на этот вопрос, вспомните, из чего состоит человеческое тело? На 70% из воды. А соль регулирует и поддерживает водный баланс в организме. Другими словами, исключить соль - то же, что исключить дыхание. Но отсюда же вытекает вывод: избыточное или недостаточное количество соли в рационе нарушает этот баланс.

25 слайд
Каждый на себе испытывал: поев соленого, пить хочется. Много. Между тем из организма при этом жидкости выводится мало. И как вы думаете, где будет храниться все выпитое? В жировых клетках. Они напитываются жидкостью и значительно увеличиваются в объеме. Именно поэтому проблемные места часто отекают. Много соли - задержка жидкости - нарушение обменных процессов - нагрузка на сердце и сосуды, проблемы с почками. Да еще нарушение обмена веществ и повышение аппетита от соленой еды опять-таки провоцирует набор веса.

26 слайд
Постоянный же недосол еды, наоборот, приводит к тому, что жидкости выводится больше и начинают интенсивно выводиться нужные микроэлементы (в частности, кальций, который важен для крепости костей, быстрого роста и красоты ногтей и волос)..